雌雄两性的存在是生物界中最为普遍的现象之一。通常,一个物种的雌雄个体在形态、繁殖策略和行为上会有着显著的差别。然而,造就这一普遍现象的遗传机制却非常的多样,并且经常与物种发生关系树不相符。脊椎动物拥有着多种性别决定机制,例如哺乳动物是雄性异配型的决定机制(即雌性XX,雄性XY),而鸟类是雌性异配的机制(即雌性ZW、雄性ZZ)。在其他脊椎动物如鱼类、两栖类和爬行类中,性别决定则可由多种因素控制,包括由性染色体决定(如XY或ZW),由性别决定基因决定,以及由环境因素决定。我们利用比较基因组学和功能基因组学的方法,对不同物种性染色体的演化历程以及表观调控机制在环境性别决定系统中作用等方面进行研究。
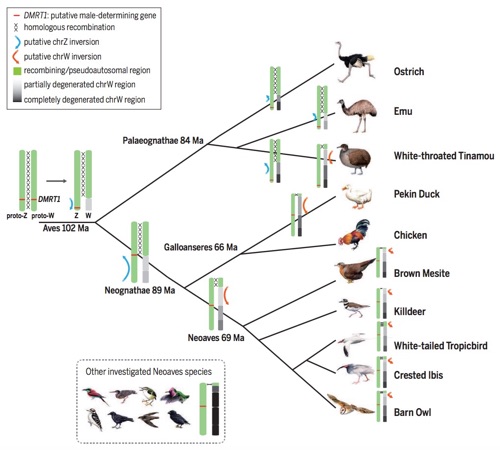
例如,作为此前国际鸟类生命之树项目的其中一个子项目,我们对17种新测序的代表性鸟类的基因组进行研究,还原了鸟类ZW性染色体的演化过程(Science 2014)。随着B10K项目科级别工作的开展,我们将会利用更多的鸟类基因组数据来对整个鸟纲的性染色体演化历史进行更深入的分析。我们将会尤其关注平胸目——现存鸟纲中最接近祖先状态的一支,因为我们之前的研究表明这一支的鸟类拥有同型的性染色体,其ZW染色体对在很大范围内还能进行广泛的同源重组,并拥有大范围的假常染色体区域(PAR),暗示着平胸目的性染色体仍然保持着鸟类祖先性染色体的状态。
自然界中的性别决定机制大体上可以分为两大类:遗传性别决定(genetic sex determination,GSD)和环境性别决定(environmental sex determination,ESD)。一般来说,具有遗传性别决定机制的物种,性别特征会伴随物种的整个生命周期。然而对于某些GSD物种而言,最初的性别却可以在发育时期被改写,以至于一些个体可以在不改变其基因型的前提下发育出完全相反的性别特征。这种现象称为环境性别逆转(environmental sex reversal, ESR)。ESR相对普遍地存在于昆虫、鱼类、两栖类和爬行类之中。半滑舌鳎(Cynoglossus semilaevis)是一种使用雌性异配性别决定系统(ZW♀/ZZ♂)的经济鱼种。尽管其主要的性别决定方式是通过性染色体的继承,然而一定比例的遗传雌鱼(ZW)可以在正常饲养温度下(22˚C)发生性逆转最终发育成表型上的雄鱼(伪雄鱼),而且高温诱导(28˚C)可使性逆转率大大提高。因此半滑舌鳎是用来研究表观调控机制(如DNA甲基化)如何介导GSD到ESD转变的理想模型。
我们之前对半滑舌鳎基因组的研究重建了其Z/W性染色体的起源与演化历程,并发现舌鳎的Z/W染色体与鸟类的Z/W染色体均起源于祖先脊椎动物中的同一对原始常染色体对(Nature Genetics 2014)。通过比较伪雄鱼、正常雄鱼和雌鱼之间性腺的DNA甲基化图谱,我们发现性别决定通路中的基因在性逆转过程中发生了大量DNA甲基化修饰的改变,而且在伪雄鱼中发生的甲基化变化大部分都被其ZW后代个体继承,这也许解释了为什么伪雄鱼的后代不需要高温诱导即可大量的发生性别逆转 (Genome Research 2014)。这项研究表明表观调控机制在半滑舌鳎性逆转过程中发挥了多重关键的角色。同时我们第一次回答了具有性染色体的物种在发生性逆转后如何处理性染色体上的基因的剂量不平衡问题。最后,我们提出伪雄鱼家系中性染色体的偏向性传递和性逆转的跨代表观继承之间可能具有密切关系。为了进一步理解环境因素(比如高温)如何影响鱼类发育以及改变其性别决定通路,我们将继续利用这个物种作为模型,通过产生更多的DNA甲基化和组蛋白修饰数据来对这一问题作更深入的研究。
关于种内或种间的表型变异是否可以通过顺式调控元件的改变从而导致基因表达模式的改变这一机制来实现,学术界已经争议了数十年。我们至今对一些在物种演化史上具有飞跃性意义或者对物种适应新环境具有重要贡献的新表型如何产生的遗传机制仍然知之甚少。其中一个比较著名的例子就是恐龙到鸟类的演化,因为这一过程需要产生许多演化上的革新,例如飞行能力以及翅膀和飞羽的获得等。尽管人们此前已经对鸟类及其近缘物种进行了大量古生物学和解剖学方面的研究,但这些新表型产生背后的遗传机制仍未被知晓。我们推测,跟鸟类特异性状有关的基因或者这些基因的顺式调控元件会在整个鸟纲中受到强烈的选择约束,且与非鸟类的物种有着显著的差异。基于这一假设,我们从48只鸟的全基因组比对结果中鉴定到了大量的鸟类特异性高度保守元件(avian-specific highly conserved elements,ASHCEs),并且这些元件有99%都是落在基因组的非编码区域(Nature Communications 2017)。结合对鸡的胚胎和肢芽的组蛋白修饰数据的综合分析,我们发现ASHCEs极可能作为顺式调控元件起作用。
上述发现促使我们继续探究ASHCEs对鸟类特异性状的发育调控作用。我们通过比较鸟类和其它脊椎动物的肢芽基因表达模式,鉴定出了一系列在鸟类中具有特殊表达模式的基因。特别值得一提的是,我们的实验证实了Sim1基因在鸟类飞羽的发育过程中起到了关键的调控作用,并且Sim1基因上的ASHCE对其鸟类特异的表达模式具有开关的作用。我们的工作也为未来的研究提供了一个范本,即通过整合基因组学、发育生物学和古生物学的分析方法,可以更准确地识别出跟不同类群种系特异性的表型革新有关的基因组变异特征。我们推测实际上还有更多具有功能的ASHCEs 协调着其他鸟类特异性状的发育调控,其中有些也许还和鸟类的祖先兽脚类的恐龙共享并作为宏观演化的遗传基础。因此,我们计划通过比较鸟类和其他脊椎动物胚胎中更多不同组织的转录组和组蛋白修饰数据,来进一步挖掘ASHCEs在其他鸟类特异形状发育过程中的潜在调控作用。